本研究旨在基于硼中子俘获治疗(BNCT)开发一种新的肺肿瘤和病灶转移的治疗诊断学方法。它依靠低密度脂蛋白(LDL)作为载体,能够大限度地选择性摄取肿瘤细胞中的硼原子,同时通过磁共振成像(MRI)定量硼在体内的分布。肿瘤细胞摄取最初通过电感等离子体质谱和MRI对四种肿瘤(TUBO、B16-F10、MCF-7、A549)和一种健康(N-MUG)细胞系进行评估。BALB/c小鼠静脉注射Her2+乳腺癌细胞株(即TUBO)产生肺转移,采用转基因EML4-ALK小鼠作为原发肿瘤模型。中子照射MRI后观察肿瘤生长30-40天。B治疗小鼠肿瘤团块的增加明显慢于对照组。
肺癌仍然是与癌症有关的死亡的主要原因,每年在全世界造成159万人死亡。肺是原发肿块治疗后转移性疾病和肿瘤复发最常见的部位。由于肺肿瘤主要播散在肺实质内,切除通常困难且不易消除,中位生存时间少于1年。基于这些原因,重要的是开发出能够在细胞水平上区分健康和病理组织的侵袭性较低的治疗方法。
硼中子俘获疗法(BNCT)是一种实验性的双放射疗法,目前正受到密切关注,用于治疗癌症,特别是头颈部复发肿瘤、1例皮肤黑色素瘤、2例肝脏转移疾病和脑瘤。它是基于热中子捕获的10B核之前把B输送到肿瘤细胞。
硼中子捕获事件导致形成激发11B衰变发射高度电离的4He2+和7Li3+离子。细胞死亡是由这些带电粒子的能量释放引起的,这些带电粒子在其运行轨迹上产生约5-9毫米范围内的电离轨道。
因此,如果10B原子选择性地积聚在细胞内空间,就有可能在不影响邻近健康细胞的情况下破坏肿瘤细胞。据估计,如果有合适的中子源,并考虑到可接受的辐照时间,每克肿瘤块大约需要10-30ug硼才能获得可接受的治疗优势。
这一事实使BNCT成为治疗弥散性肿瘤的一种有前途的选择,如肺转移,这些肿瘤无法通过手术、常规光子疗法或重离子疗法等需要对病理组织进行精确定位的方法来治疗。选择性地向肿瘤细胞输送硼对增加体内硼含量至关重要,同时维持周围健康组织和血液中的低浓度,以大限度地减少损害。
目前,两种BNCT药物用于临床研究即:i) L-paraboronophenylalanine (BPA),结构上相关的氨基酸苯丙氨酸,已经用于临床试验治疗胶质母细胞瘤,头部和颈部复发癌症和黑色素瘤7 ii)钠mercaptoundecahydro-closo-dodecaborate (BSH)一直追究恶性神经胶质瘤的治疗。尽管BPA和BSH在临床应用中表现出较低的选择性,但许多研究小组都在努力开发新的选择性更强的硼给药剂。为此,人们对多核硼衍生物,特别是碳硼烷进行了广泛研究。碳硼烷是一种含10个硼原子的二十面体笼型化合物,因其硼含量高、化学性能好、体内稳定性好等特点,被广泛应用于硼输送载体的设计中。碳硼烷类药物可通过小的靶向部分功能化,包括氨基酸、维生素、碳水化合物、卟啉酸等以达到对肿瘤的选择性。选择性地将硼引入肿瘤细胞的另一种策略是基于多个碳硼烷与单克隆抗体的共价结合,或将其与脂质体、14,15低密度脂蛋白16-18 (LDL)或其他纳米颗粒结合。尽管目前已有许多碳硼烷衍生物在临床前研究中取得了显著的成果,但尚未在临床环境中得到应用。达到这一目标的关键问题是评估肿瘤组织中硼的含量。为了进行中子辐照,这一点是很重要的,因为只有当硼浓度达到阈值,并且根据治疗目标和保留正常组织执行适当的剂量处方时,才能预期成功的结果。目前,在临床试验中使用经验数据模型来估计肿瘤中的硼浓度,该模型依赖于肿瘤与血液、肿瘤与大脑和大脑与血液的硼浓度比。其中一个问题是,硼的摄取和分布在不同的患者,存在很大的不确定性的肿瘤-血硼浓度比。只有基于分子如何进入健康细胞和癌细胞的改进知识,设计适当的中子捕获疗法(NCT)药剂,才能达到最佳的细胞内浓度,使NCT成为治疗癌症的有效疗法。此外,利用无创、高灵敏度的成像技术,可以在中子治疗前实时检测肿瘤中硼的浓度。其中一些方法需要NCT试剂的功能化和适当的成像报告器,如用于正电子发射断层扫描(PET)的18F原子,用于磁共振成像(MRI)的含有Gd/Fe的介质或19F原子用于19F- nmr。
PET和MRI的检测范围都低于执行治疗所需的硼阈值。PET的敏感性较高,但有进一步放射性管理的缺点,MRI似乎是一种合适的技术,以实现定量评估NCT制剂在组织的目标。虽然与核磁共振和光学模式相比,它的灵敏度较低,但MRI的高空间分辨率(<100um)提供了详细的形态和功能信息,而且由于没有电离辐射,它比基于放射性同位素的技术更安全。MRI信号依赖于水的纵向(T1)和横向(T2)质子弛豫时间,在临床和实验中,内源性造影剂(CA)的使用可降低组织中水质子分布的T1和T2,从而改变内源性造影剂。在质子磁共振图像中,观察到的信号强度(SI)增强和CA的浓度成正比。
因此,这些试剂可用于对其与中子捕获化合物的连接进行间接的硼定量。有趣的是,当每个细胞的Gd3+复合物数在108-109个数量级时,即接近提供有效NCT治疗所需硼原子数的阈值时,一个给定的细胞可以通过MRI显示出来。
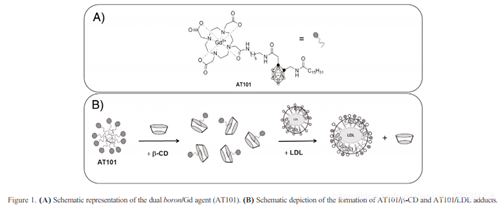
本研究的目的是测试磁共振治疗诊断造影剂在BNCT治疗肺肿瘤和转移的有效性。静脉注射Her2+乳腺癌细胞系(TUBO)可产生肺转移。Her2过表达在大约20%的人类乳腺癌中被检测到,它与侵袭性病程和早期转移发展有关。几种抗Her2策略已经被批准,革命性地改变了Her2+乳腺癌的临床结果,但在大多数情况下,继发的药理学耐药使这种治疗完全无效。在这方面,迫切需要制定新的战略。作为肺原发肿瘤的模型,我们使用了一种转基因(Tg)小鼠细胞系模型,该模型在肺泡上皮细胞中特异性SP-C启动子24下体外表达致癌EML4-ALK融合蛋白。在所有Tg小鼠中,EML4-ALK蛋白均在肺上皮细胞特异表达。所有的EML4-ALK转基因小鼠出生后几周内,双肺出现许多腺癌结节,且外显率为100%,这是融合激酶EML4-ALK强致癌活性的结果。本研究中使用的双MRI/BNCT制剂能够通过靶向LDL受体(LDLRs),最大限度地选择性摄取肿瘤细胞中的硼,同时通过MRI定量硼在肿瘤和其他组织中的分布。由于低密度脂蛋白在许多肿瘤中表达上调,低密度脂蛋白被认为是硼聚集的良好载体。此外,这些纳米颗粒可以携带大量的硼原子而不失去特定的内化途径。在NCT处理中,AT101配体被富含同位素157的GdCl3螯合,以利用其约255000barns的高热中子截面。这个截面提供了大约65倍的改进,一个10B中子捕获。157Gd的核反应迅速产生宽能谱的γ射线,与俄歇电子和x射线竞争。由于它们的范围很短(小于0.5 nm到1.4um), 157Gd原子必须定位在靶细胞的细胞核,与DNA接触,以诱导足够的损伤,导致细胞凋亡,并获得有效的治疗。
10B富集配体-C -[N-(dotama - c6)- carbamoylmethyl]C ' -棕榈氨基甲基-o-carborane (10B富集AT101)按照补充材料17中描述的先前报道的步骤合成。
细胞和动物辐照在帕维亚大学的TRIGA Mark II反应器的热柱中进行(意大利)。实验方案在补充材料中有描述。辐照设施以前是TAOrMINA治疗而设计的。TRIGA最大功率为250kw,截面为40×20 cm2,长度为1 m,从堆芯中心约1.3 m处开始。辐照时间固定在15分钟,反应堆功率为30 kW,对应的热中子通量为1.26·1012 cm−。根据国家规定进行了动物实验,并得到了当地伦理委员会的批准。(一堆中子反应,依然不懂)。动物模型的制备在补充材料中有描述。用补充材料中报道的公式29计算肿瘤、组织和器官中的硼浓度。
治疗前3周,将50000个TUBO细胞注入尾静脉,制备小鼠模型。第一组小鼠(n = 15)照射前6小时给予AT101/LDL (0.1 mmol/kg Gd剂量)。第二组(辐照对照组,n = 15)同时接受相同体积的PBS。第三组未受辐射的小鼠(n = 10)作为参考,在没有任何治疗的情况下评估肿瘤的生长情况。TRIGA Mark II的中子场没有准直,即在肺部照射时,动物的整个身体都间接暴露在中子场中。为了保护动物身体的健康器官,用一种盾牌制成采用95%富6Li的Li2CO3粉末作为中子吸收剂,因为6Li中子捕获后没有二次伽马辐射。(一堆生物实验和中子辐照保护)
采用模拟代码蒙特卡罗N - particle (MCNP)设计处理方案。利用Westcott公式对铜导线的激活进行中子通量测量,验证了模拟的有效性。在采用的实验设置中,5只小鼠同时照射,每只小鼠头部和腹部区域均有2单位的Li2CO3中子防护罩保护。各单元之间保持约1厘米的距离,以保证肿瘤直接暴露在中子通量之下。
2、“体外”细胞摄取实验和MRI分析
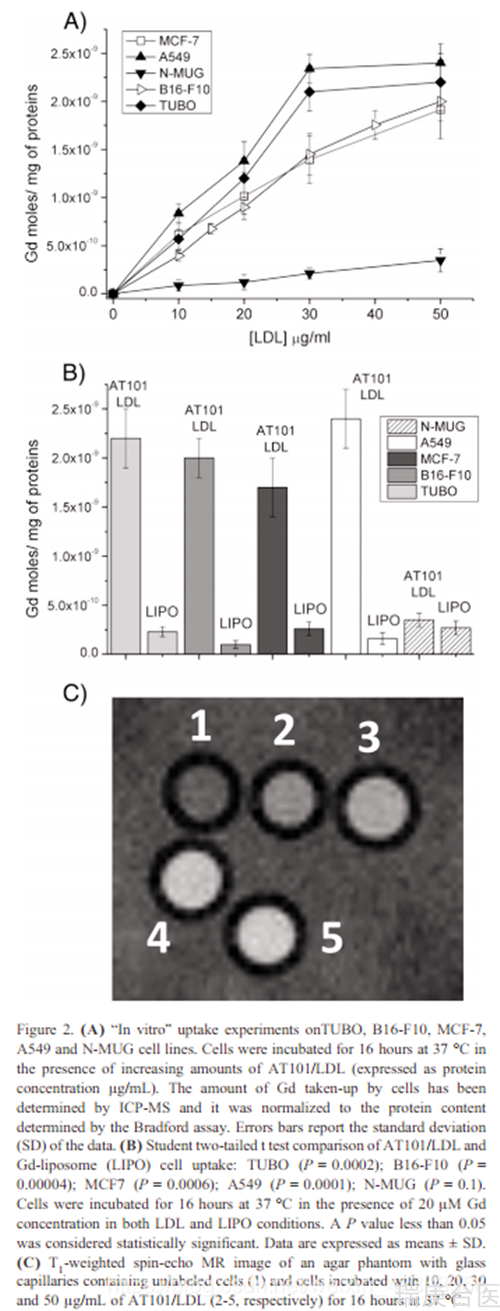
采用上述方法,AT101/LDL加合物含ca。每个蛋白制备230个Gd配合物。TUBO是一个Her2 +建立的细胞系,来自于一个自发的乳腺肿瘤产生于一个处女转基因BALB-neuT雌性老鼠。在这些小鼠中,乳腺癌变显示了一个组织病理学过程,与在人类乳腺肿瘤中观察到的过程密切相似,32制造了这个小鼠模型,以及从中提取的管状细胞,这是一个测试抗癌疗法的理想工具。正如已经报道的,许多肿瘤细胞的特征是LDL转运体的上调。以评估其吸收能力,在增加数量的AT101/低密度脂蛋白嗜盐剂的存在下培养LDLRs、TUBO细胞,37摄氏度下16个小时。冷PBS洗涤后,收集细胞,ICP-MS检测Gd含量。为了考虑每个样品中存在的不同数量的细胞,Gd的量被归一化为总蛋白浓度。我们将TUBO细胞(图2,A)与小鼠黑色素瘤(B16-F10)、人乳腺癌(MCF-7)、人肺腺癌(A549)和健康小鼠乳腺细胞(N-MUG)使用相同的孵育方案获得的结果进行了比较。图2,A显示肿瘤细胞(TUBO, B16-F10, MCF-7, A549)对AT101/LDL的内化作用在浓度范围内明显高于健康N-MUG细胞。后细胞生存能力采用MTT试验评估AT101/LDL孵育情况(图S1补充材料)。培养基中LDL浓度为25ug/毫升,足以将足够量的硼内化到靶细胞中进行BNCT。事实上,Gd浓度为1.7×10−9 mol /mg,对应的细胞内硼浓度为28ppm(考虑到1g组织包含1×109个细胞,1mg蛋白对应6×106个TUBO细胞)。如果周围组织中硼的浓度至少低三倍,并且如果在可接受的照射时间内能够给病人提供足够的中子通量,则该浓度足以达到成功的治疗。为了证明TUBO细胞摄取AT101/LDL加合物涉及到LDLRs,我们进行了与本地LDL竞争的实验。在AT101/LDL加合物(20ug/ml)的存在下培养16小时后,当培养基中加入的原生LDL浓度为200ug/毫升时,细胞摄取减少了约50%。此外,为了排除AT101/LDL摄取是这些细胞系内吞率差异的结果,我们对非靶向的、含隐形脂质粒35(LIPO)摄取的Gd-DOTAMA(C18)进行了比较。图2,B显示,在所有考虑的肿瘤细胞中,Gd的内在化量明显低于AT101/LDL孵育时的测量值(P < 0.0006)。相反,健康的N-MUG细胞在LDL和脂质之间没有显示显著差异(P = 0.1),表明两种颗粒的内吞摄取不是特异性的。(一堆看不懂的实验设计)为了评估Gd在靶细胞中的内化量是否足以使MRI显示,在7t时获得含细胞微球的玻璃毛细血管的T1加权图像,该图像是通过增加TUBO细胞的LDL/AT101的数量来获得的(图2,C)。T1加权图像清楚地显示,与对照组相比,在低密度脂蛋白/AT101孵育下的细胞SI高。正如预期的那样,SI与LDL浓度成正比
3、肺转移患者体内AT101/LDL颗粒摄取的评价
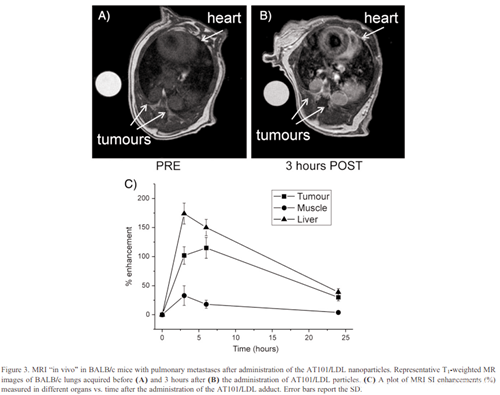
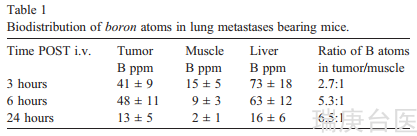
在MRI分析和BNCT治疗前3周,静脉注射5万TUBO细胞,建立肺转移小鼠模型。此时所有小鼠都出现了许多直径为0.5-2毫米的肺转移。荷瘤小鼠(n = 4)接受(iv)一次性注射AT101/LDL,剂量为0.1 mmol kg-1(以Gd含量表示)。在CA给药前、3小时、6小时和24小时分别获得t1加权自旋回波磁共振图像。在注射低密度脂蛋白/AT101前和注射后3小时肺部转移的典型t1轴位图像分别见于图3、A和B。图3,C报告了不同时间间隔的平均SI增强(%)。正如预期的那样,由于在肿瘤细胞和正常肝细胞上高表达的LDLRs,在肿瘤区域和肝脏中可以观察到高%的SI增强。在此基础上,在BNCT治疗期间,肝脏必须受到中子屏蔽的保护(药物在肿瘤和肝脏区域聚集??)。
按照上述方法,注射后3、6和24小时,在肿瘤、肌肉(肺周围)和肝脏中计算出的硼浓度如表1所示。肿瘤内硼浓度明显高于设定的20/ 30ppm阈值,适合高效的BNCT治疗。硼原子浓度的比率来自于肿瘤和周围肌肉的浓度的比较。根据这些结果,选择静脉注射后6小时为最佳时间进行BNCT。事实上,此时肿瘤中的高硼浓度(48ppm)与肿瘤/肌肉的高硼比结合在一起,这是避免健康组织损伤的基本条件。
4、BNCT“体外”治疗TUBO细胞
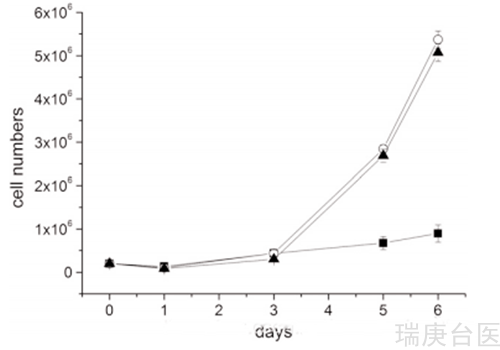
在BNCT研究中,AT101配体被螯合到Gd3+在同位素157中富集。7个T75烧瓶,4个TUBO细胞之前在AT101/LDL(50°g/mL蛋白浓度)中培养16小时,3个未处理的对照组细胞在TRIGA Mark II反应器的热柱中照射15分钟。辐照管细胞内硼浓度为36ppm。在辐照结束时,将培养基取出并用新鲜的DMEM代替,并将烧瓶置于37℃、5% CO2的加湿气氛中。24小时后分离细胞,计数并重新镀以观察其增殖情况。本实验使用了两个细胞控制。第一组不接受任何中子辐照和任何含硼化合物,第二组不使用含硼化合物辐照。经硼处理的细胞在辐照下存活的增殖率明显低于对照组细胞的增殖率(图4)。在此基础上,我们可以得出结论,细胞内硼量足以对中子通量暴露产生剧烈的毒性作用。
5、辐射设置和辐射剂量计算
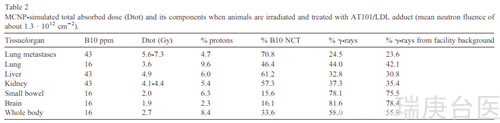
小鼠的中子辐照使用与细胞相同的辐照设备。为了限制肝脾吸收的中子剂量,AT101 /低密度脂蛋白积累在这些器官和限制中子引起放射性物质在整个动物,吸收中子盾牌由95% 6 li-enriched Li2CO3粉已经使用只留下胸腔地区对应的肺,暴露在中子通量(图S2补充料)。为了了解在肿瘤和健康组织/器官中释放的辐射剂量,使用了一个专门研究中子和光子在复杂几何(MCNP)中的传输的模拟程序。由于point-wise nuclear cross data,辐射/物质相互作用得到了仔细的再现。利用MRI和MCNP模拟测量的B浓度,计算组织吸收的总剂量(Dtot),以及下列各剂量成分:i) 14N上中子俘获反应发射的高线性能量转移(LET)质子,1H上弹性散射发射的高线性能量转移(%质子);ii)中子俘获反应在10B上发射的二次辐射(治疗部分;% 10B NCT);iii)γ射线,包括入射中子的光子污染(facility background);iv)热中子捕获反应1H的2.2 MeV的射线(% γ射线)(表2和3)。
为了进行安全的治疗,我们对野生型BALB/c小鼠(n = 15)进行了初步照射,使用所述的屏蔽,不给含硼化合物的药。辐照时间从10到20分钟,反应器功率保持在250kw。根据这些结果(在图S3中作为补充材料报告),考虑到刚刚描述的毒性和在真实NCT中组织中增强捕获剂的存在,NCT的照射时间被固定在15分钟。为了评估这种治疗方案的安全性,将剂量与对小鼠全身X射线或γ射线照射的约7 Gy的耐受极限进行比较。同时计算了157Gd中92.3%的富集所引起的剂量贡献。正如预期的那样,生物效应主要来自于俄歇电子,它传输的总能量只有157Gd捕获反应的一小部分。因此,就吸收剂量而言,这种辐射的贡献是相当低的。MCNP模拟报告了在肺转移中总剂量的增加,如表2所示约为5-6%,而在健康组织中相同的增加可高达约10%,这取决于Gd浓度、器官位置和屏蔽。
6、BNCT治疗肺转移
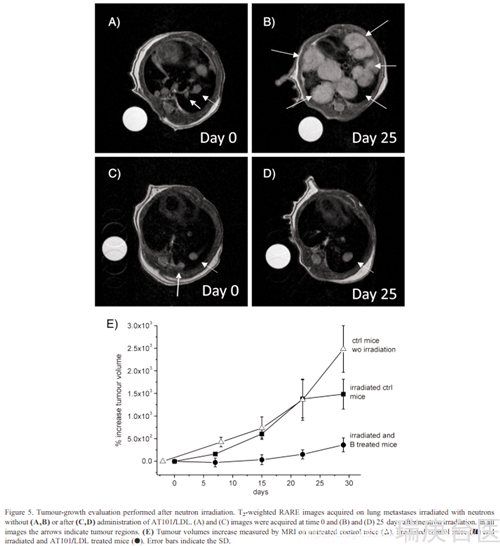
BALB/c小鼠(n = 40)在BNCT治疗前3周静脉注射50000 TUBO细胞。这导致了几个肺转移的形成,MRI使用t2加权RARE序列显示。转移的数目在不同的小鼠之间有显著的差异(从5到20)。在给AT101/LDL治疗3小时后,MRI测定瘤内硼浓度为43±10 ppm,而在周围健康肌肉中发现16±5 ppm。两组动物(每组15只)接受辐照治疗。在中子暴露前6小时,第一组接受Gd剂量0.1 mmol/kg对应硼剂量10 mg/kvg的AT101/LDL。第二组(辐照对照组)接受相同体积的PBS,以评估在无AT101/LDL的情况下中子辐照的效果。第三组未受辐射的小鼠(n = 10)作为参考,评估在没有任何治疗和辐射的情况下肿瘤的生长情况。MRI使用t2加权RARE序列监测肿瘤大小(图5,a - d)。在BNCT后的前5天内,未检测到受辐射和治疗的动物肿瘤大小的增长(图5,E)。只有在较长时间后,肿瘤病灶才缓慢地重新开始生长。
7、BNCT对EML4-ALK转基因小鼠的治疗
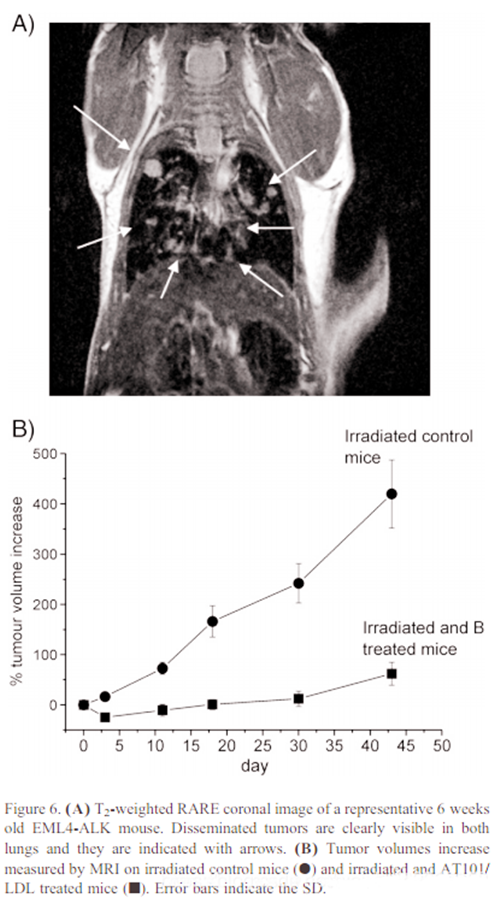
EML4-ALK转基因小鼠同样接受上述处理。照射当天,6周龄EML4-ALK小鼠肿瘤体积在0.5-15 mm3之间(图6,A)。BNCT治疗前3h,通过MRI测量给予AT101/LDL前后的T1加权图像肿瘤区域的SI增强情况,肿瘤和周围肌肉的B浓度分别为52±12和16±5ppm。在此基础上,我们有可能得出结论,在这个模型中,硼的瘤体内量足以预期在中子暴露后肿瘤大小显著下降。由于在这些健康组织中检测到的硼浓度降低了三倍,预计对周围肌肉的毒性作用有限。本研究考虑了两组小鼠。第一组(n = 5)在中子暴露前6小时接受Gd剂量0.1 mmol/kg AT101/LDL。第二组(辐照对照组;n = 5)接受相同体积的PBS,以评估在没有AT101/LDL的情况下中子辐照的效果。图6,B显示,在前30天,经硼处理后的小鼠的肿瘤生长可以忽略不计。
该程序基于使用硼/Gd双纳米载体的BNCT对肿瘤体的破坏,为肺癌治疗开辟了一个有前景的治疗机会,特别是在存在弥散性肿瘤的情况下。这种方法已经在乳腺癌转移(通过注射乳腺导管癌TUBO细胞获得)和ALK-EML4转基因小鼠肺癌发生模型上进行了测试,这些模型发展成与人类癌症形态相似的高度侵袭性肿瘤。
在本文中,利用成对的Gd CA的存在,通过MRI间接测量硼浓度的可能性,对于在给硼后的最有利时间和适当的中子通量进行最佳治疗时间是至关重要的。事实上,只有给予肿瘤足够的剂量,而正常组织吸收的剂量保持在耐受剂量下,才能预期成功的结果。为了达到这一结果,三个因素的结合是必要的:肿瘤中适当的硼浓度,肿瘤与正常组织的高比率,以及足够的中子通量,以在可接受的时间照射动物。两种小鼠模型在治疗后25-30天左右观察到的肿瘤再生长可能有两种解释:i)这可能与肿瘤团块中存在的静止细胞(quiescent cells)有关,已经证明这些细胞有更大的能力从辐射和化疗药物诱导的损伤中恢复。此外,观察到这些细胞对靶向治疗的高耐药性可能是由于相对于高增殖细胞,靶受体表达较低的结果;ii)放射到肺肿瘤的中子剂量不足以杀死所有细胞。这可能是为了保护动物,屏蔽装置和中子辐照获得的治疗效果之间的折中。实际上,由于靠近AT101/LDL聚集的肺和肝脏,很难设计和定位碳酸锂保护层,既能保护健康组织,又能使肿瘤暴露在中子照射下。这个问题本质上与动物的小尺寸有关,在使用准直和选择性中子束的临床应用中可以克服。此外,由于ALK-EML4小鼠模型的遗传来源,在中子照射一周后,观察到新的肿瘤团块的形成。在照射时,这些小的肿瘤团块完全没有,因此不受中子治疗的影响,或者它们的直径为b0.2 mm, MRI无法检测到。在小病变的情况下,血管内给药的AT101/LDL摄取量减少,因为这些病变还没有形成分布的血管系统,硼的输送通过血管系统进行。
最后,从这些结果可以推测,BNCT与化疗药物的使用以及美国光动力疗法等不同的治疗策略的结合可能是值得寻求的。这些治疗应在中子照射后的30-40天内给予,此时肿瘤的体积显著减少。
注:文章及图文来源网络等、侵删,如果您需要了解BNCT技术、设备、专家、治疗等方面,我司可以提供BNCT协助服务。
成都瑞庚医疗科技咨询有限公司
公司网址丨www.ruigeng.net
公司邮箱丨rg@ruigeng.net
洽询电话丨028-61985320
微信客服丨18982287599
微信公众号丨瑞庚台医

 微信扫码
微信扫码
 意见反馈
意见反馈
 热线电话
热线电话

 ivy-客服
ivy-客服